Sikkerhetsprofil
TIDES: Sikkerhetsdata
TIDES: Effektstudie av tetravalent immunisering mot dengue hos friske barn [2], [3]
QdengaTM har til dags dato generelt blitt tolerert godt i TIDES [1], [2], [3]
I TIDES:
- Ingen viktige sikkerhetsrisikoer er blitt observert i TIDES opptil 4,5 år etter den andre dosen med QdengaTM [1], [2], [3]
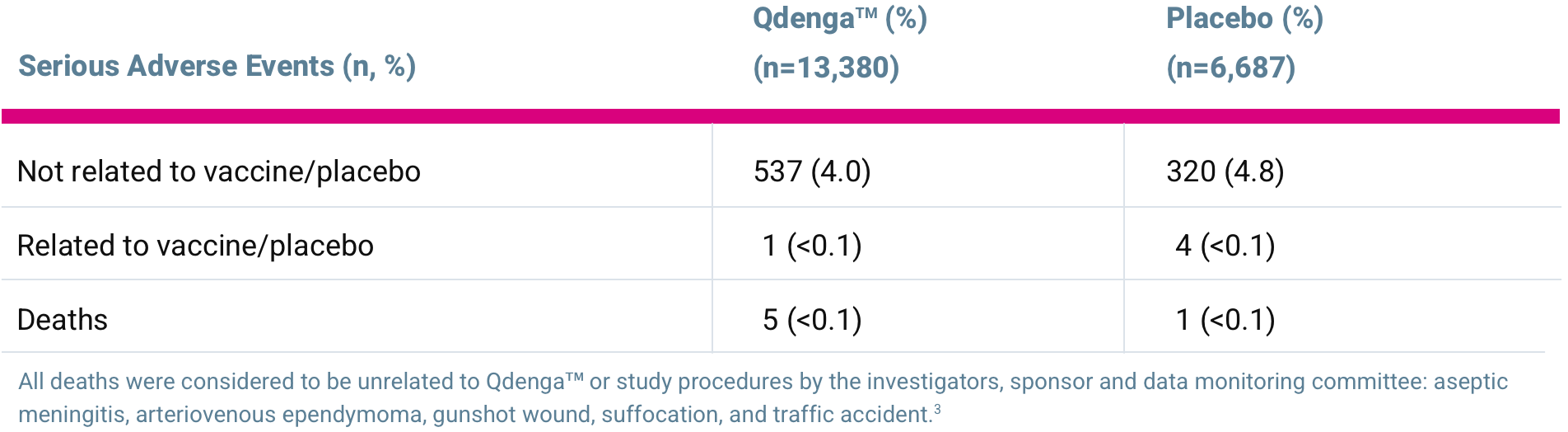
- Lignende kumulative forekomster av alvorlige AE-er ble observert for personer som ble behandlet med QdengaTM og placebo [3]
- opptil 18 måneder etter den andre dosen: henholdsvis 4,0% vs. 4,8%
- i samsvar med forventede medisinske forstyrrelser i studiepopulasjonen
- Ingen tegn til dags dato på at QdengaTM forverret sykdommens alvorlighetsgrad hos seronegative personer [1], [3]
- Alvorlige AE-er hadde en forekomst på 4,3% for både seropositive (624/14 520) og seronegative personer (238/5547) opptil 18 måneder etter den andre dosen
Oversikt over alvorlige uønskede hendelser i TIDES-sikkerhetssettdataene*, mellom måned 1 og 18 etter den andre dosen med QdengaTM [3]
Utprøverne, sponsoren og dataovervåkingskomitéen betraktet alle dødsfallene som urelatert til QdengaTM
eller studieprosedyrene: Aseptisk meningitt, arteriovenøs misdannelse av de cerebrale karene, anaplastisk ependymom, skuddsår, kvelning og trafikkulykke. [3]
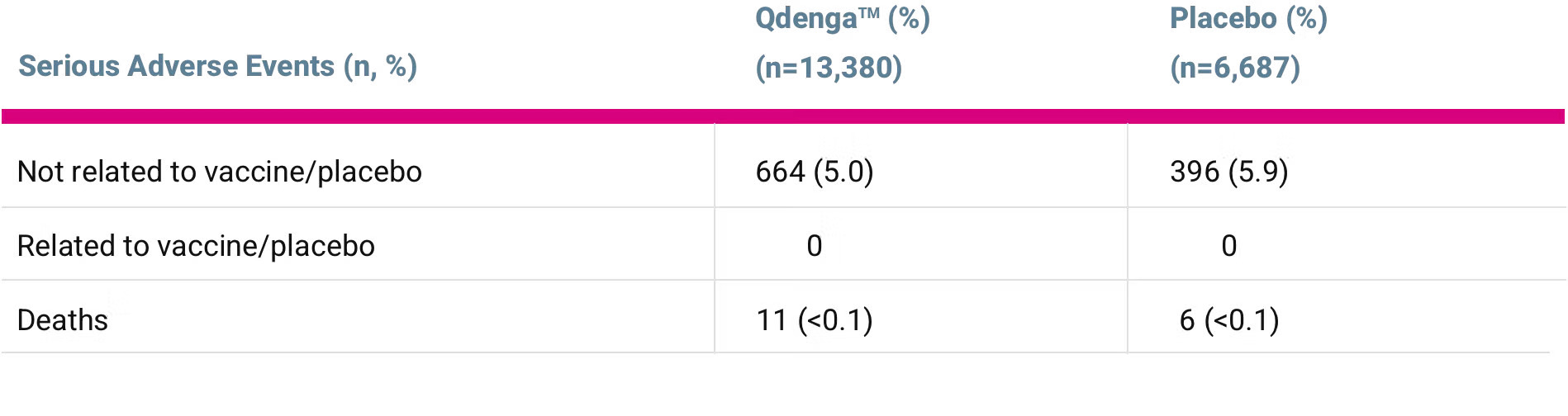
Oversikt over alvorlige uønskede hendelser i TIDES-sikkerhetssettdataene*, mellom måned 19 og 54 etter den andre dosen med QdengaTM
*Som vurdert av utprøveren [3]
Den totale kliniske sikkerheten til QdengaTM
Den totale sikkerhetsprofilen til QdengaTMer basert på en stratifisert analyse som inkluderte seronegative personer, som bestod av 14 627 deltakere i alderen 4–60 år (13 839 barn og 788 voksne) som hadde blitt vaksinert med QdengaTM, inkludert en reaktogenisitetsundergruppe med 3830 deltakere (3042 barn og 788 voksne) [1]
- De vanligste uønskede hendelsene i de kliniske studiene var milde til moderate, og hadde en kort varighet (1–3 dager) [1]
- De hyppigst rapporterte reaksjonene hos pasientene i alderen 4 til 60 år var smerter på injeksjonsstedet, hodepine, myalgi, erytem på injeksjonsstedet, ubehag, asteni og feber [1]
- Uønskede reaksjoner oppstod mindre hyppig etter den andre injeksjonen enn etter den første injeksjonen [1]
- Hyppighet, type og alvorlighetsgrad av uønskede reaksjoner hos barn tilsvarte de som ble sett hos voksne [1]
- QdengaTM har liten innvirkning på evnen til å kjøre og bruke maskiner [1]
- Forbigående vaksineviremi ble observert i en klinisk studie (DEN-205), og var forbundet med milde til moderate symptomer med en gjennomsnittsvarighet på 4 dager, og ble sjeldent sett etter den andre dosen med QdengaTM [1]
- Se produktinformasjonen for hele sikkerhetsprofilen, spesielle advarsler, forholdsregler og kontraindikasjoner for bruk av QdengaTM
Uønskede reaksjoner fra kliniske studier (i alderen 4 til 60 år) [1]
Uønskede reaksjoner står oppført etter følgende hyppighetskategorier: Svært vanlig (≥ 1/10), vanlig
(≥ 1/100 til < 1/10), uvanlig (≥ 1/1000 til < 1/100), sjelden (≥ 1/10 000 til < 1/1000) og svært sjelden (< 1/10 000) [1]
a Inkluderer infeksjon i øvre luftveier og virusinfeksjon i øvre luftveier
b Inkluderer faryngotonsilitt og tonsilitt
c Funnet hos barn under 6 år i kliniske studier
d Inkluderer utslett, virusutslett, makulopapulært utslett, kløende utslett
e Rapportert hos voksne i kliniske studier
AE, adverse event; CI, confidence interval; DCAC, dengue case adjudication committee; DENV, dengue virus; DHF, dengue hemorrhagic fever; GMT, geometric mean titer; RT-PCR, reverse transcription polymerase chain reaction; VCD, virologically confirmed dengue; WHO, World Health Organization