Advate «Takeda (Takeda AS)»
Rekombinant koagulasjonsfaktor VIII-konsentrat. ATC-nr.: B02B D02
PULVER OG VÆSKE TIL INJEKSJONSVÆSKE,
oppløsning 250 IE, 500 IE, 1000 IE, 1500 IE, 2000 IE og 3000 IE: Hvert sett inneh.: I) Hetteglass med pulver: Oktokog alfa (rekombinant koagulasjonsfaktor VIII 250 IE, resp. 500 IE, 1000 IE, 1500 IE, 2000 IE og 3000 IE, mannitol, na¬triumklorid, histidin, trehalose, kalsiumklorid, trometamol, polysorbat 80, glutation. II) Hetteglass med oppløsningsvæske: Vann til injeksjonsvæsker 2 ml eller 5 ml. Innhold etter rekonstituering i sett med 5 ml oppløsningsvæske: Ca. 400 IE, resp. 600 IE oktokog alfa/ml. Innhold etter rekonsti¬tuering i sett med 2 ml oppløsningsvæske: Ca. 125 IE, resp. 250 IE, 500 IE og 750 IE oktokog alfa/ml.
Indikasjoner:
Behandling og profylakse av blødninger hos pasienter med hemofili A (medfødt faktor VIII-mangel). Er indisert for alle aldersgrupper.
Dosering:
Mht. sporbarhet skal preparatnavn og batchnr. noteres i pasientjournalen. Behandling skal startes under veiledning av lege med erfaring i hemofilibehandling og med mulighet for gjenopplivning umiddelbart tilgjengelig i tilfelle anafylakse.
Overvåkning av behandlingen: Under behandlingen anbefales fastsettelse av faktor VIII-nivåer som veiledning for valg av dose og frekvens. Responsen på faktor VIII kan variere, og vise ulike halveringstider og tilhelinger. Dose basert på kroppsvekt kan kreve justering hos undervektige eller overvektige pasienter. Spesielt ved større kirurgiske intervensjoner, er nøye overvåkning av substitusjonsbehandlingen vha. koagulasjonsanalyse (faktor VIII-aktivitet i plasma) helt nødvendig.
Generelt: Dosering og behandlingsvarighet avhenger av hvor alvorlig faktor VIII-mangelen er, lokalisering og grad av blødning samt klinisk tilstand. En internasjonal enhet (IE) av faktor VIII-aktivitet er ekvivalent med mengden faktor VIII i 1 ml normalt humant plasma.
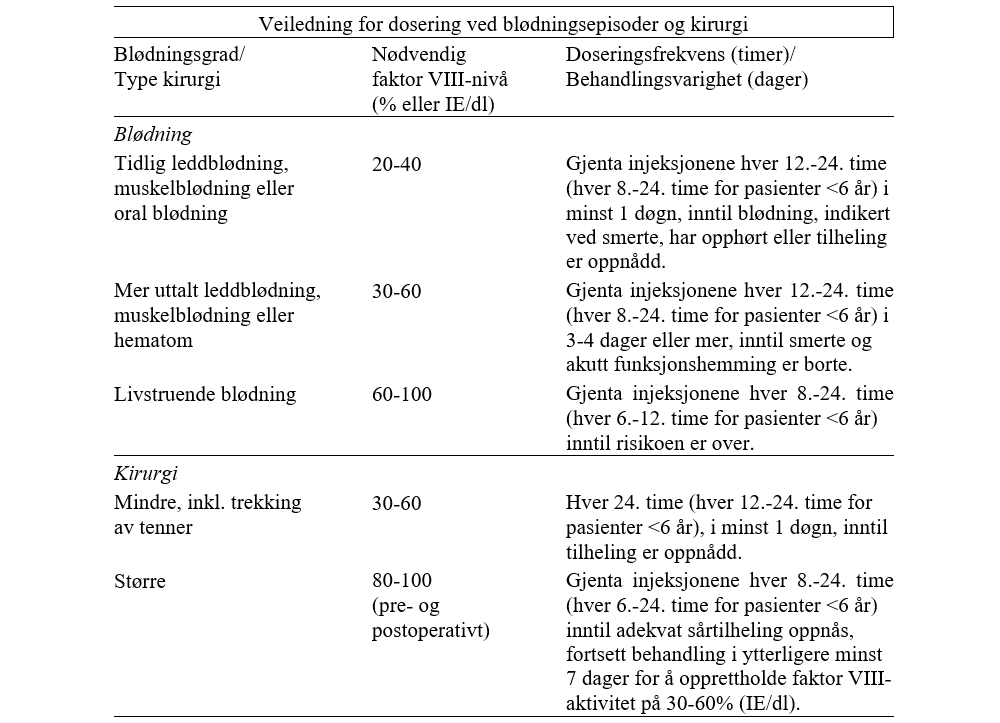
Symptomatisk behandling: Nødvendig dose kalkuleres fra empiriske data, som viser at 1 IE faktor VIII/kg kroppsvekt øker faktor VIII-aktiviteten i plasma med 2 IE/dl. Dosen bestemmes vha. formelen: Nødvendige enheter (IE) = Kroppsvekt (kg) × ønsket faktor VIII-økning (%) × 0,5. Dose og administreringshyppighet skal alltid tilpasses klinisk respons. I visse tilfeller (f.eks. ved tilstedeværelse av inhibitor med lav titer) kan det være nødvendig å gi høyere doser enn kalkulert. I følgende blødningstilfeller skal faktor VIII-aktiviteten ikke falle under angitt nivå av plasmaaktivitet (i % av normaltilstand eller IE/dl) i korresponderende periode. Dosene hos barn og ungdom 0-18 år avviker ikke fra voksne.
Ved langvarig blødningsprofylakse hos pasienter med alvorlig hemofili A: Normal dosering er 20-40 IE/kg kroppsvekt i intervaller på 2-3 dager. I noen tilfeller, spesielt hos yngre pasienter, kan det være nødvendig med kortere doseringsintervall eller høyere doser. Barn <6 år anbefales doser på 20-50 IE/kg 3-4 ganger i uken.
Tilberedning/Håndtering: Se pakningsvedlegget for hetteglass 250 IE, 500 IE, 1000 IE og 1500 IE eller pakningsvedlegget for hetteglass 2000 IE og 3000 IE. Etter rekonstituering er oppløsningen klar, fargeløs, uten fremmedpartikler og har en pH på 6,7-7,3. Skal ikke blandes med andre legemidler eller oppløsningsmidler. Kun vedlagt oppløsningsvæske og utstyr skal brukes.
Administrering: Skal gis i.v. Administreringshastigheten skal tilpasses for å sikre at det er behagelig for pasienten, maks. 10 ml/minutt. Gjøres administrering av ikke-helsepersonell må passende opplæring iverksettes.
Kontraindikasjoner: Overfølsomhet for innholdsstoffene. Kjent allergisk reaksjon overfor mus- eller hamsterprotein.
Forsiktighetsregler:
Forsiktighetsregler: Overfølsomhet: Overfølsomhetsreaksjoner av allergisk type, inkl. anafylakse, er rapportert. Inneholder spor av proteiner fra mus og hamster. Ved symptomer på overfølsomhet skal behandlingen avbrytes umiddelbart og lege kontaktes. Pasienten skal informeres om tidlige tegn på overfølsomhetsreaksjoner, inkl. urtikaria, generalisert urtikaria, tilsnøring i brystet, hvesing, hypotensjon og anafylaksi. Ved sjokk skal standard medisinsk behandling iverksettes. Styrkene 250 IE, 500 IE, 1000 IE og 1500 IE: Pga. mindre volum ved rekonstitusjon i 2 ml oppløsningsvæske for disse styrkene, er det mindre tid til å reagere mht. stans av injeksjonen hvis overfølsomhetsreaksjoner inntreffer. Det tilrådes derfor å utvise forsiktighet under injeksjon med disse styrkene rekonstituert med 2 ml oppløsningsvæske, spesielt hos barn.
Inhibitorer: Dannelse av nøytraliserende antistoffer (inhibitorer) mot faktor VIII er en kjent komplikasjon i behandling av hemofili A. Inhibitorer er vanligvis IgGer rettet mot faktor VIIIs prokoagulerende aktivitet, og kvantifisert i Bethesda-enheter (BE)/ml plasma ved bruk av den modifiserte analysen. Risiko for å utvikle inhibitorer er korrelert til alvorlighet av sykdom samt eksponering av faktor VIII, størst risiko innen de første 50 eksponeringsdagene, men fortsetter gjennom hele livet, selv om risikoen er mindre vanlig. Klinisk relevans av inhibitorutvikling avhenger av dens titer. Inhibitorer med lav titer utgjør en mindre risiko for utilstrekkelig klinisk respons enn inhibitorer med høy titer. Pasienten bør overvåkes nøye mot utvikling av inhibitorer vha. kliniske observasjoner og laboratorietester. Hvis forventet faktor VIII‑aktivitet i plasma ikke oppnås, eller hvis blødning ikke kan kontrolleres med passende dose, skal test utføres for å bestemme om faktor VIII‑inhibitor er tilstede. Ved høye inhibitornivåer er det mulig at substitusjonsbehandling med faktor VIII ikke har effekt, og andre terapeutiske muligheter må vurderes. Behandlingen av slike pasienter skal ledes av lege med erfaring i behandling av hemofili og inhibitorer mot faktor VIII.
Feilbruk: Styrkene 250 IE, 500 IE, 1000 IE og 1500 IE: For disse styrkene, rekonstituert i 2 ml oppløsningsvæske, kan feil bruk (intraarterielt eller paravenøst) føre til milde, kortvarige reaksjoner på injeksjonsstedet, som blåmerker og erytem.
Kardiovaskulære hendelser: Ved eksisterende kardiovaskulære risikofaktorer kan substitusjonsbehandling med faktor VIII øke den kardiovaskulære risikoen.
Kateterrelaterte komplikasjoner: Hvis det kreves en enhet for sentral venetilgang (CVAD), skal risikoen for CVAD-relaterte komplikasjoner inkl. lokale infeksjoner, bakteriemi og trombose på kateterstedet, tas i betraktning.
Hjelpestoffer: Inneholder 0,45 mmol (10 mg) natrium pr. hetteglass, tilsv. 0,5% av WHOs anbefalte maks. daglige inntak for voksne. Inneholder 0,5 mg polysorbat 80 pr. hetteglass.
Bilkjøring og bruk av maskiner: Ingen/ubetydelig påvirkning på evnen til å kjøre bil eller bruke maskiner.
Interaksjoner: For utfyllende informasjon om relevante interaksjoner, bruk interaksjonsanalyse. Ingen interaksjoner mellom legemidler med humane koagulasjonsfaktorer VIII (rDNA) og andre legemidler er sett.
Graviditet, amming og fertilitet:
Graviditet: Ingen erfaring. Studier på dyr er ikke utført. Skal kun brukes hvis det er klart indisert. Amming: Skal kun brukes under amming hvis det er klart indisert.
Bivirkninger:
Overfølsomhet eller allergiske reaksjoner (som kan omfatte angioødem, flushing, frysninger, generalisert urtikaria, hodepine, hvesing, hypotensjon, kribling, kvalme, letargi, oppkast, rastløshet, svie og stikkende følelse på infusjonsstedet, takykardi, tilsnøring i brystet, urtikaria) er observert sjelden og kan i noen tilfeller utvikle seg til alvorlig anafylaktisk reaksjon (inkl. sjokk). Utvikling av antistoffer mot proteiner fra mus og/eller hamster med relaterte overfølsomhetsreaksjoner kan observeres. Utvikling av nøytraliserende antistoffer (inhibitorer) kan forekomme hos pasienter med hemofili A, som behandles med faktor VIII. Hvis slike inhibitorer dannes, vil tilstanden vises som en utilstrekkelig klinisk respons. I slike tilfeller anbefales det å kontakte en sykehusavdeling som er spesialisert innen hemofili. Svært vanlige (≥1/10): Blod/lymfe: Faktor VIII-inhibering (tidligere ubehandlede pasienter). Vanlige (≥1/100 til <1/10): Generelle: Feber. Nevrologiske: Hodepine. Mindre vanlige (≥1/1000 til <1/100): Blod/lymfe: Faktor VIII-inhibering (tidligere behandlede pasienter), lymfangitt. Gastrointestinale: Diaré, kvalme, oppkast, øvre abdominalsmerter. Generelle: Brystsmerter, brystubehag, frysninger, føle seg unormal, hematom på karpunksjonsstedet, perifert ødem. Hjerte: Palpitasjoner. Hud: Hyperhidrose, kløe, urtikaria, utslett. Infeksiøse: Influensa, laryngitt. Kar: Hematom, hetetokter, pallor. Luftveier: Dyspné. Nevrologiske: Dysgeusi, migrene, svekket hukommelse, svimmelhet, synkope, tremor. Skader/komplikasjoner: Blødning etter prosedyre, komplikasjon etter prosedyre, reaksjon på prosedyrestedet. Undersøkelser: Redusert hematokrit, redusert koagulasjonsfaktor VIII-nivå, unormale laboratorietester, økt monocyttall. Øye: Øyeinflammasjon. Ukjent frekvens: Generelle: Malaise, reaksjon på injeksjonsstedet, utmattelse. Immunsystemet: Anafylaktisk reaksjon, overfølsomhet [1]. Barn og ungdom: Bortsett fra utvikling av inhibitorer hos tidligere ubehandlede pediatriske pasienter og kateterrelaterte komplikasjoner, er det ikke registrert aldersspesifikke ulikheter i bivirkninger. For ytterligere informasjon, se SPC.
Egenskaper:
Klassifisering: Rekombinant koagulasjonsfaktor VIII uten von Willebrands faktor. Er produsert vha. DNA-teknologi i kinesiske hamstereggceller. Virkningsmekanisme: Samme effekt som koagulasjonsfaktor VIII fra humant plasma. Aktivert faktor VIII fungerer som kofaktor for aktivert faktor IX, og akselererer omdannelsen av faktor X til aktivert faktor X, som omdanner protrombin til trombin. Trombin omdanner fibrinogen til fibrin, og blodpropp kan dannes.
Oppbevaring og holdbarhet:
Uåpnet hetteglass: Oppbevares i kjøleskap (2-8°C). Skal ikke fryses. Oppbevar forseglet blisterpakning i ytteremballasjen for å beskytte mot lys. Kan oppbevares ved romtemperatur (<25°C) i en enkeltperiode som ikke overskrider 6 måneder. Sluttdato for 6 måneders oppbevaring i romtemperatur bør angis på esken. Ved utløp av denne perioden skal preparatet brukes eller kasseres. Preparatet skal ikke settes tilbake i kjøleskap igjen. Etter rekonstituering: Bør fra et mikrobiologisk synspunkt brukes umiddelbart. Brukeren er ansvarlig for oppbevaringstid og -forhold, som normalt bør være <3 timer ved 25°C.
Pakninger og priser:
250 IE: 1 sett1 (Baxject III-system, hettegl. + 2 ml oppløsningsvæske) kr 2100,70. 500 IE: 1 sett1 (Baxject III-system, hettegl. + 2 ml oppløsningsvæske) kr 4117,20. 1000 IE: 1 sett1 (Baxject III-system, hettegl. + 2 ml oppløsningsvæske) kr 8111,00. 1500 IE: 1 sett1 (Baxject III-system, hettegl. + 2 ml oppløsningsvæske) kr 12327,90. 2000 IE: 1 sett1 (Baxject III-system, hettegl. + 5 ml oppløsningsvæske) kr 16400,00. 3000 IE: 1 sett1 (Baxject III-system, hettegl. + 5 ml oppløsningsvæske) kr 24572,40.
Refusjon:
1. H-resept: B02B D02_23. Koagulasjonsfaktor VIII
Finansiering over helseforetakene: Der det er utarbeidet nasjonale handlingsprogrammer/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/LIS spesialistgruppe skal rekvirering gjøres i tråd med disse.
Vilkår: (216) Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist.
Sist endret: 28.07.2025
Basert på SPC godkjent av DMP/EMA: 21.05.2025